Hmm, a jak to jest naturalne zjawisko, tylko rzadko występujące?

|
|
Partenogeneza (z greckiego παρθενος, „dziewica” oraz γενεσις „narodziny”), dzieworództwo – odmiana rozmnażania traktowana najczęściej jako płciowa (z powodu udziału gamety) pomimo braku zapłodnienia[1], polegająca na rozwoju osobników potomnych z komórki jajowej bez udziału plemnika. W botanice jest rodzajem apomiksji, utraty zdolności do rozmnażania płciowego – amfimiksji[2].
Partenogeneza może być traktowana jako cecha przystosowawcza. W warunkach stałego (stabilnego) środowiska o dużych, niewykorzystanych zasobach, partenogeneza umożliwia (tak jak i rozmnażanie bezpłciowe) szybkie zwiększenie liczebności populacji[3] (zobacz też: pomnażanie). W warunkach zmiennego środowiska lub środowiska z zaburzeniami, korzystniejszą strategią jest rozmnażanie płciowe, które umożliwia większą różnorodność potomstwa, na skutek m.in. rekombinacji genetycznej. Adaptacyjne cechy dzieworództwa widoczne są wyraźnie w przypadku partenogenezy geograficznej, ekologicznej, cyklicznej i pedogenezy. Odmianą partenogenezy jest pedogeneza, która występuje np. u owadów: niektórych gatunków mszyc i chrząszczy, polega na przemiennym występowaniu w cyklu życiowym larw zdolnych do rozmnażania dzieworodnego. Do rozwoju partenogenetycznego można doprowadzić w sposób sztuczny, np. nakłuwając komórkę jajową żaby igłą zanurzoną wcześniej w krwi żaby. Do sztucznej partenogenezy doprowadzić można także działając bodźcami elektrycznymi lub chemicznymi na komórki jajowe. W ten sposób udało się zapoczątkować rozwój u żab, niektórych ryb, a nawet królika[4]. Spis treści 1 Historia badań nad partenogenezą 2 Przykłady dzieworództwa 3 Partenogeneza u ssaków 4 Rodzaje partenogenezy 4.1 Partenogeneza stała 4.2 Partenogeneza geograficzna 4.3 Partenogeneza ekologiczna 4.4 Partenogeneza cykliczna 4.5 Partenogeneza hemozygoidalna 4.6 Partenogeneza zygoidalna 4.7 Partenogeneza mejotyczna 4.8 Partenogeneza amejotyczna 4.9 Partenogeneza fakultatywna 5 Ekologiczne uwarunkowania partenogenezy 6 Zobacz też 7 Przypisy 8 Bibliografia Historia badań nad partenogenezą Pierwszym odkrywcą partenogenezy (u mszyc) był Charles Bonnet. W 1740 Bonnet dostarczył do Francuskiej Akademii Nauk referat odnośnie do zjawiska, które współcześnie zwane jest partenogenezą u tych pluskwiaków. Odkrywcą partenogenezy u pszczół był Jan Dzierżon (1845) – polski pszczelarz i naukowiec, który odkrył, że trutnie powstają z niezapłodnionej komórki jajowej (nie mają ojca). Jego teoria była przez wiele lat powodem gwałtownych sporów naukowych, ponieważ w owym czasie powszechnie wierzono, że każdy żywy organizm musi posiadać ojca i matkę. Przykłady dzieworództwa Przykładem organizmów rozmnażających się dzieworodnie są niewielkie skorupiaki wodne – rozwielitki, inaczej dafnie. Od wiosny do jesieni samice rozwielitki składają jaja, z których – bez zapłodnienia – rozwijają się kolejne pokolenia samic. Jednak jaja te nie są odporne na niesprzyjające warunki środowiska. Jesienią z niektórych jaj rozwijają się samice, a z innych samce. W wyniku typowego rozmnażania płciowego powstają tak zwane jaja zimowe o grubszej osłonce, zdolne do przezimowania. Partenogeneza występuje u pszczół, os, chruścików z rodzaju Apatania, jedwabnika morwowego, wielu innych owadów i niektórych innych stawonogów (np. roztocza). Spotykana u nielicznych ryb, płazów i gadów. Spośród bezkręgowców występuje u wrotków, nicieni, skorupiaków, roztoczy i owadów. Spośród nielicznych partenogenetycznych gadów wyróżnić można jaszczurki z rodzaju Lacerta żyjące w górach Kaukazu, północnoamerykańskie jaszczurki z rodzaju Cnemidophorus, gekony z wysp Oceanu Spokojnego czy warany z wysp Komodo. W 2007 roku taką możliwość rozmnażania zaobserwowano u rekina młota. Obserwacji tych dokonano w ogrodzie zoologicznym w mieście Omaha (stan Nebraska, USA)[5]. W maju tego samego roku odkryto partenogenetyczną ciążę w ciele samicy rekina czarnopłetwego, która padła przed porodem. Odkrycia dokonano w Oceanarium stanu Wirginia (ang. Virginia Aquarium), USA[6]. W roku 2010 zaobserwowano partenogenezę u samicy rekina w akwarium w Karlsruhe[7]. Partenogeneza u ssaków U ssaków prawidłowy rozwój embrionu wymaga udziału zarówno genomu matczynego, jak i ojcowskiego. Ssacze zarodki zawierające jedynie matczyny materiał genetyczny obumierają na wczesnym etapie embriogenezy, u myszy – w ciągu 10 dni, u owcy i świni – 21 dni[8]. Przeszkodą w rozwoju embrionów ssaków na drodze partenogenezy jest imprinting genomowy[9][8]. W kwietniu 2004 roku na łamach „Nature” naukowcy poinformowali o wyhodowaniu myszy o imieniu Kaguya, pierwszego zdolnego do życia ssaka partenogenetycznego[9][10]. Rodzaje partenogenezy W zależności od gatunku dzieworództwo może być jedyną lub sezonową formą rozmnażania, zależnie od temperatury otoczenia lub dostępu do pożywienia. Wyróżnia się wtedy odpowiednio partenogenezę obligatoryjną lub fakultatywną (geograficzna, ekologiczna). Trzecią formą partenogenezy jest partenogeneza cykliczna, będąca częścią cyklu rozwojowego i występująca na przemian z rozmnażaniem obupłciowym. Partenogeneza stała Partenogeneza stała (obligatoryjna) występuje wtedy, gdy głównym lub jedynym sposobem rozmnażania jest dzieworództwo. W populacji występują tylko samice. Jeśli pojawiają się rzadko samce, to nie osiągają dojrzałości płciowej i nie biorą udziału w rozmnażaniu[1]. Partenogeneza obligatoryjna występuje na przykład u patyczaków – owadów żyjących w stałych środowiskowo i bogatych w pokarm warunkach klimatu tropikalnego. Partenogeneza geograficzna Partenogeneza geograficzna występuje wtedy, gdy jedne populacje danego gatunku w części geograficznego zasięgu występowania rozmnażają się płciowo, a część populacji zasiedlające inne regiony geograficzne rozmnażają się dzieworodnie. Taki typ partenogenezy zaobserwowano u niektórych chrząszczy z rodziny Curculionidae[1]. Partenogeneza ekologiczna Partenogeneza ekologiczna występuje w przypadku, gdy część populacji danego gatunku rozmnaża się w jednym środowisku płciowo, a część populacji, zasiedlających inne środowisko rozmnaża się przez partenogenezę. Taką partenogenezę zaobserwowano u ślimaka Paludestrina jenkensii, który rozmnaża się partenogenetycznie w środowisko morskim, natomiast w wodach śródlądowych rozmnaża się płciowo[1]. Partenogeneza cykliczna Partenogeneza cykliczna występuje wtedy, gdy przemiennie występują pokolenia rozmnażające się dzieworodnie i rozmnażające się płciowo. Taka przemiana pokoleń wiąże się z cyklicznymi zmianami środowiska (stałość i stabilność a zaburzenia i nieciągłość środowiska). Partenogeneza cykliczna występuje u motylicy wątrobowej, mszyc, wioślarek i niektórych muchówek. zobacz też: heterogonia Partenogeneza hemozygoidalna Z niezapłodnionych jaj mogą powstawać tylko samce – mówimy wtedy o arrhenotokii. Samce tak powstałe nie mają ojca a wszystkie ich komórki są haploidalne. Partenogeneza hemozygoidalna występuje u niektórych roztoczy i błonkówek Partenogeneza zygoidalna Partenogeneza zygoidalna zachodzi w przypadku, gdy organizmy powstałe w wyniku rozmnażania dzieworodnego są diploidalne. W ten sposób mogą powstawać albo wyłącznie samice (telitokia) albo obie płcie (deuterotokia, zwana też amfitokią). Znane są dwie drogi utrzymywania diploidalności w trakcie partenogenezy; partenogeneza mejotyczna (gdy podczas spermatogenezy i oogenezy zachodzi mejoza) i amejotyczna: Partenogeneza mejotyczna Podczas spermatogenezy i oogenezy zachodzi mejoza. Podwojenie liczby chromosomów może mieć miejsce w wyniku endomitozy lub zachodzi łączenie się jąder haploidalnych jeszcze w trakcie bruzdkowania. Partenogeneza mejotyczna zachodzi stosunkowo rzadko, zaobserwowane zostało u niektórych skorupiaków Entomostraca, u muszki owocowej (Drosophila parthenogenetica), waranów z wysp Komodo oraz u niektórych czerwców (Insecta: Homoptera: Coccina)[1]. Partenogeneza amejotyczna Partenogeneza amejotyczna – częściej występujący sposób zachowania diploidalności w rozmnażaniu dzieworodnym. Brak jest mejozy w czasie dojrzewania komórek rozrodczych. Ten typ partenogenezy zaobserwowano u wioślarek, równonogów, niektórych owadów (karaczany, pasikoniki, muchówki, ryjkowce, mszyce, czerwce), a także u mięczaków[1]. Partenogeneza fakultatywna Z niezapłodnionych jaj składanych przez samice – matkę lub trutówkę – rozwijają się osobniki męskie (np. trutnie u pszczół). Trutówki to pszczoły robotnice, które w odpowiednich warunkach uzyskują zdolność do rozmnażania, u których wcześniej wytwarzają się jajniki. Składają one jaja, nie mają jednak zdolności do kopulacji i zapłodnienia. Z tak złożonych jaj mogą jednak wykluć się tylko trutnie. W ten sposób w ulu pojawia się tak zwany czerw garbaty, który jest jednym z najbardziej charakterystycznych sygnałów, że w ulu nie ma królowej-matki, nie pozwala to na przetrwanie roju – same trutnie, czyli osobniki płci męskiej nic nie poradzą, jeśli w rodzinie pszczelej nie będzie zdolnej do zapłodnienia matki. Ekologiczne uwarunkowania partenogenezy Wynikiem partenogenezy jest wysoka płodność, jednak kosztem zmienności genetycznej. Pozwala ona w krótkim czasie opanować bogate źródła pożywienia, które pojawiają się efemerycznie. Zawodzi jednak w zmieniających się warunkach środowiska, kiedy organizmy partenogenetyczne wykazują gorsze przystosowanie na skutek małej zmienności genetycznej populacji. Partenogeneza (tak jak i inne formy pomnażania) korzystna jest w stałych, stabilnych warunkach środowiskowych z dużą ilością zasobów pokarmowych. W warunkach zmiennego środowiska, nieregularnych zaburzeń i katastrof korzystniejsza jest strategia rozmnażania płciowego. W populacjach niektórych stawonogów obserwuje się cykliczne zmiany pokoleń rozmnażających się płciowo i dzieworodnie (zobacz heterogonia). Wioślarki (skorupiaki, Cladocera) wiosną i latem mają w toni wodnej dużo pokarmu (rozwijające się glony) w tym czasie obserwuje się w środowisko pokolenia partenogenetyczne. Pokolenie rozmnażające się płciowo pojawia się jesienią. Podobna przemiana pokoleń występuje u mszyc. U roztoczy glebowych wiosną, na skutek wyższej temperatury, dostępne są zeszłoroczne, opadłe liście jako baza pokarmowa[1]. 
|
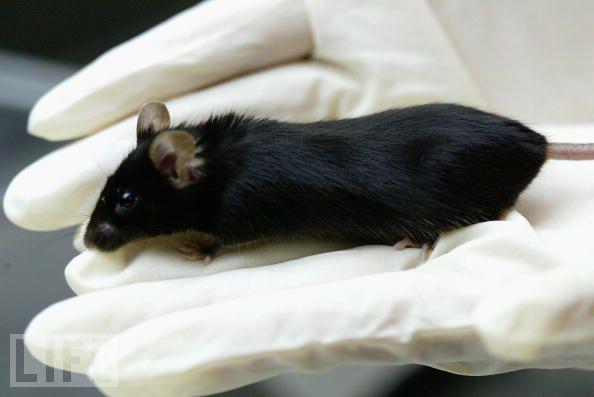 Mysz Kaguya Przejdź do nawigacji Przejdź do wyszukiwania Mysz Kaguya (3 lutego 2003 – 2005[1]) – mysz domowa, pierwszy ssak powstały z połączenia materiału genetycznego dwóch samic, który dożył wieku dorosłego[2][3]. Kaguya urodziła się 3 lutego 2003 roku i padła po 793 dniach, co wskazywało, że posiadanie genów od dwóch samic może wydłużać długość życia[1]. Była pierwszym zdolnym do życia ssakiem partenogenetycznym[4]. Jej imię zaczerpnięto z japońskiej baśni o księżycowej księżniczce Kaguya-hime[3]. Rozmnażanie partenogenetyczne występuje m.in. u roślin, owadów i gadów[3][5]. U ssaków prawidłowy rozwój embrionu wymaga udziału zarówno genomu matczynego, jak i ojcowskiego. Ssacze zarodki zawierające jedynie matczyny materiał genetyczny obumierają na wczesnym etapie embriogenezy, u myszy – w ciągu 10 dni, u owcy i świni – 21 dni[6]. Przeszkodą w rozwoju embrionów ssaków na drodze partenogenezy jest imprinting genomowy[4][6]. Spis treści 1 Przebieg eksperymentu 1.1 Analiza fenotypów 1.2 Analiza ekspresji genów 2 Przypisy Przebieg eksperymentu Kaguya była rezultatem eksperymentu przeprowadzonego przez zespół naukowców pod kierownictwem Tomohiro Kono, biologa z Tokyo University of Agriculture. Wyhodowano ją dzięki zwiększeniu aktywności genu Igf2 i monoallelicznej ekspresji genu H19 w partenogenetycznych zarodkach. W tym celu stworzono zmodyfikowane genetycznie myszy mające delecję o wielkości 13 kb (tysięcy par zasad) w jednostce transkrypcyjnej i regionie o zróżnicowanej metylacji genu H19, które zostały dawcami oocytów. Delecja ta umożliwiła ekspresję Igf2[2][5]. W normalnym embrionie ekspresji ulega matczyna kopia genu H19 i ojcowska kopia genu Igf2. Rozwój zarodka zawierającego wyłącznie ojcowskie chromosomy (H19 jest wyciszony) jest upośledzony i kończy się jego śmiercią. W embrionie zawierającym wyłącznie matczyne chromosomy (Igf2 jest wyciszony) dochodzi do niedorozwoju tkanek pozazarodkowych, co skutkuje jego obumarciem[5]. Zmodyfikowane genetycznie myszy uzyskano przez iniekcję celowanych komórek CCE ES do blastocyst myszy ze szczepu C57BL/6J, a następnie skrzyżowano wstecznie z samicami ze szczepu C57BL/6J. Od powstałych jednodniowych myszy pobrano oocyty w diplotenie[2]. DNA tych komórek nie miało w pełni nałożonego matczynego imprintingu, przez co imitowały one plemniki[2][3][5]. Od myszy ze szczepu B6D2F1 pobrano oocyty na etapie pęcherzyka zarodkowego i owulowane oocyty w metafazie II. Następnie za pomocą inaktywowanego wirusa Sendai dokonano fuzji oocytów diplotenowych z pozbawionymi jąder oocytów na etapie pęcherzyka zarodkowego. Zrekonstruowane oocyty hodowano w pożywce MEM przez 14 godzin do osiągnięcia przez nie stadium metafazy II. Potem ich jądra przeniesiono do owulowanych oocytów w metafazie II. Następnie zrekonstruowane oocyty aktywowano chemicznie. Uzyskane embriony hodowano przez 3 dni w pożywce M16, w atmosferze 5% dwutlenku węgla, 5% tlenu i 90% azotu, w temperaturze 37 °C[2][6]. Otrzymane blastocysty wszczepiono do macic 26 samic, z czego 24 zaszły w ciążę. Łącznie wszczepiono 343 zarodki, z czego 246 (71,7%) się zagnieździło. Na świat przyszło 28 młodych, z czego 18 martwych i 10 żywych. Z 10 żywo urodzonych młodych przy życiu utrzymały się tylko 2, reszta była opóźniona w rozwoju i padła w ciągu 15 minut. Z dwóch myszy, które przeżyły, jedną nazwano Kaguya, dożyła ona okresu dorosłości i po kopulacji z samcem wydała na świat zdrowe potomstwo. Drugą mysz uśmiercono w celu wykorzystania do analizy ekspresji genów. Wyniki eksperymentu opublikowano na łamach „Nature” w kwietniu 2004 roku. Dostarczyły one bezpośrednich dowodów, że imprinting genomowy blokuje rozwój ssaczych embrionów na drodze partenogenezy[2][6]. Analiza fenotypów Fenotypy myszy partenogenetycznych były podobne do grupy kontrolnej. Grubość pępowiny myszy partenogenetycznych mieściła się w normie, ale masa ich łożysk była znacząco mniejsza niż w grupie kontrolnej. Masa urodzeniowa myszy partenogenetycznych, które przeżyły, była zbliżona do masy myszy w grupie kontrolnej. Badanie histopatologiczne opóźnionych w rozwoju żywo urodzonych młodych wykazało niedorozwój wątroby i atrofię łożyska, ale z zachowaną funkcjonalnością. Masa urodzeniowa ciała była też znacząco mniejsza niż masa myszy z grupy kontrolnej[2]. Analiza ekspresji genów Analiza techniką mikromacierzy oligonukleotydowych pokazała, że[2]: wszystkie analizowane geny podlegające piętnowaniu uległy ekspresji na znormalizowanym poziomie u myszy partenogenetycznych, jedynie dwa z tych genów: Grb10 i Nnat wykazywały odpowiednio dwukrotnie zwiększoną lub dwukrotnie zmniejszoną ekspresję u myszy partenogenetycznych niż w grupie kontrolnej, od 11 do 42 (średnio 30) genów wykazywało różnicę w ekspresji genów większą niż dwa razy w porównaniu z grupą kontrolną, wśród nich tylko gen Dlk1 wykazywał zmiany w ekspresji u wszystkich badanych osobników partenogenetycznych. Analiza ilościowa RT-PCR w czasie rzeczywistym wykazała, że[2]: geny IGF2 i H19 były eksprymowane na podobnym poziomie w głównych organach u myszy partenogenetycznych, co w grupie kontrolnej, gen Gtl2 był eksprymowany na poziomie dwa – cztery razy wyższym u osobników opóźnionych w rozwoju niż w grupie kontrolnej, gen Dlk1 eksprymowany był w płucach, mięśniach i sercu w grupie kontrolnej, tylko w płucach i mięśniach u myszy partenogenetycznej, która przeżyła, a u opóźnionych w rozwoju tylko w mięśniach. Badacze stwierdzili, że spadek ekspresji Gtl2 i aktywacja Dlk1 mogły być jedną z przyczyn normalnego rozwoju dwóch partenogenetycznych myszy, które przeżyły. Oba geny podlegają imprintingowi w trakcie spermatogenezy[2]. Przypisy Kawahara M, Kono T. Longevity in Mice Without a Father. „Human Reproduction”. 25 (2), s. 457–461, 2010. DOI: 10.1093/humrep/dep400. PMID: 19952375. Kono T, et al. Birth of Parthenogenetic Mice That Can Develop to Adulthood. „Nature”. 428 (6985), s. 860–864, 2004. DOI: 10.1038/nature02402. PMID: 15103378. [dostęp 2016-03-02]. Vogel G. Japanese Scientists Create Fatherless Mouse. „Science”. 304 (5670), s. 501–503, 2004. DOI: 10.1126/science.304.5670.501a. PMID: 15105467. Moore T, Ball M. Kaguya, the First Parthenogenetic Mammal – Engineering Triumph or Lottery Winner?. „Reproduction”. 128 (1), s. 1–3, 2004. DOI: 10.1530/rep.1.00311. PMID: 15232058. Loebel DA, Tam PP. Genomic Imprinting: Mice Without a Father. „Nature”. 428 (6985), s. 809–811, 2004. DOI: 10.1038/428809a. PMID: 15103360. Kono T. Genomic Imprinting Is a Barrier to Parthenogenesis in Mammals. „Cytogenetic and Genome Research”. 113 (1–4), s. 31–35, 2006. DOI: 10.1159/000090812. PMID: 16575160 |
«
Wróć do Magiczna Kawiarenka
|
1 przeglądaj|%1 wyświetleń
| Free forum by Nabble | Edit this page |

